可用于对抗 SARS-CoV-2 和未来大流行的冠状病毒中一个有吸引力的药物靶点的结构细节今天已在eLife上发表。
该研究揭示了病毒用于逃避免疫反应的重要机制中隐藏的口袋,并表明与这些口袋之一结合的药物可以阻止病毒复制。
已知在 SARS-CoV-2 感染中发挥作用的蛋白质之一是非结构蛋白-1 (Nsp1),但其功能的研究少于病毒的其他部分,例如刺突蛋白,它用于进入人体细胞。Nsp1存在于多种冠状病毒中,其作用是帮助病毒劫持人类的蛋白质生产机器。
“据认为,Nsp1 充当守门人,阻止人类宿主制造重要的防御蛋白,同时允许冠状病毒以自己的方式接管蛋白质生产,”第一作者、博士 Alberto Borsatto 解释说。瑞士日内瓦大学学生。
“这使得它原则上成为一个有吸引力的抗病毒药物靶点,但 Nsp1 的形状使得设计潜在药物变得困难。到目前为止,在 Nsp1 表面只看到浅表层空腔,这使得药物难以附着和干扰 Nsp1 的功能。”
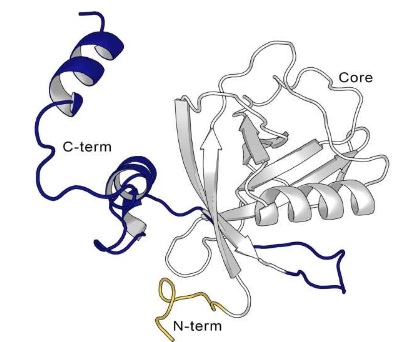
为了探索是否有可能设计出针对 Nsp1 的药物,该团队使用计算模型来研究其 3D 结构以及它在不同条件下或附着在各种分子上时如何改变形状。这揭示了四个以前未识别的绑定口袋,其中两个完全隐藏,两个部分隐藏。
为了确定这些口袋是否可以被药物靶向,该团队进行了一项实验,他们将结晶的 Nsp1 蛋白与 59 种不同的化学片段一起浸泡,这些化学片段“附着”在计算机模型中的蛋白质上。令他们惊讶的是,只有一个片段与 Nsp1 结合,位于部分隐藏的“口袋 1”中。在进一步调查中,他们发现其他三个口袋被晶体接触所遮盖,阻止了化学碎片在晶体浸泡实验中结合。
在发现口袋 1 的“命中”后,他们受到鼓舞,研究了结合该位置的药物是否会阻止 Nsp1 与蛋白质生产机器相互作用。事实上,一旦 Nsp1 处于与化学片段结合时所见的方向,它就不能再与病毒 mRNA(用于制造蛋白质的基本信使分子)相互作用。这表明靶向 Nsp1 口袋 1 的药物可以防止病毒关闭宿主的免疫系统。
 新传媒网
新传媒网